
成功の確率は22,407分の1 新薬の研究と開発の流れを解説します
製薬業界では、新薬の研究と開発が日夜行われています。一つの新薬ができるまでには様々な研究が行われ、既存の薬品も副作用の低減やさらなる高い効果を求めるために改良が繰り返されていくのです。今回は、日本の医療を支える製薬業界における新薬開発のプロセスを中心に、医薬品を巡る知的財産権のあり方や現在の新薬の動向などを解説します。
創薬と育薬

新薬は基礎研究や各種試験、国によって行われる承認審査といったプロセスを経て、はじめて医療現場で使用されることになります。しかし、世に出回ってからも薬の研究は終わりません。多くの患者に対して投与される中で安全性や有効性を繰り返し確認し、より効果があり、なおかつ安全性の高い薬へと改善が行われるのです。新薬を創り出すことを「創薬」、使用を重ねる中で薬を改良して成長させていくことを「育薬」と呼びます。
創薬
創薬は新薬が世に出回るまでの数々の研究と試験、審査のプロセス全てを含んでいます。研究に着手してから新薬が完成し、実用に至るまでにかかる期間は10年以上の歳月がかかるのが通例です。
創薬によって生み出された新薬は病気の治療や予防に役立つだけでなく、創薬の中で得られた知見が医学・薬学・化学・工学など様々な分野における先端技術の研究に活かされます。科学技術の発展において大きな役割を果たすのが創薬と言えるでしょう。
育薬
新薬が完成して世に出回った後、実際に使用された際のデータを継続的に収集します。データ収集により、創薬の段階では発見できなかった副作用を発見したり、実際の使用状況がどのようなものであるかを把握したりすることが可能です。
こうして集積されたデータをもとに、新薬の有効性や安全性をさらに高める方法や、適正に使用するための対応方法を明らかにします。さらに、患者や医療機関の意見をもとに、より利用しやすく、より安全に、より効果の高い薬を作るための改善を継続的に行うことで、薬はより良いものへと成長していきます。育薬は、創薬と同じように製薬の重要な役割を担っているのです。
新薬の開発と動向

これまで、新薬の元となる成分は、有機合成や発酵、動植物からの抽出や精製によって得られた化合物を、酵素や受容体などを用いてどのような効果をもたらすかを検定して薬効を評価する「スクリーニング」という作業によって見つけ出されてきました。その中でも、インスリンや成長ホルモンと言った一部の生物由来の薬効成分は、遺伝子組み換え技術の発達によって大量生産が可能となっています。
上記の薬効成分の大量生産に留まらず、遺伝子技術は製薬に大きな影響を及ぼしました。例えば、がん細胞の遺伝子発現を調べることで、特定の患者に向けた薬を作り出すことが可能となったのです。具体的には、がん細胞を増殖させる因子に対して作用し、その増殖を抑える抗がん剤や、病気になったときに身体が免疫反応の中で作り出す抗体を利用した抗体医薬などが挙げられます。他にも、遺伝子情報の伝達と発現に利用される核酸を応用した核酸医薬も登場し、がんや遺伝子由来の治療が難しい病気に加え、ウイルスによる感染症に対する治療への応用が期待されています。
日本製薬工業協会では、製薬企業が今後取り組んでいく必要のある施策について、2016年1月に「製薬協 産業ビジョン2025」を取りまとめました。2021年5月にはこのビジョンにいくつかの追補項目が加えられましたが、これらの追補項目ではデジタル技術の活用を特に重視しています。AIを活用した有効物質の探索やオンラインでの臨床試験、ビッグデータによる情報収集によって新たな診断法や治療法の模索を行うなど、これからの製薬にはIT技術も欠かせない要素となっていくことでしょう。
新薬の開発プロセス
新薬の開発は、非常に長い期間をかけて行われるのは先に述べたとおりですが、具体的にどのようなプロセスで創薬が行われるのでしょうか。以下では、創薬プロセスについてそれぞれの段階ごとに解説します。
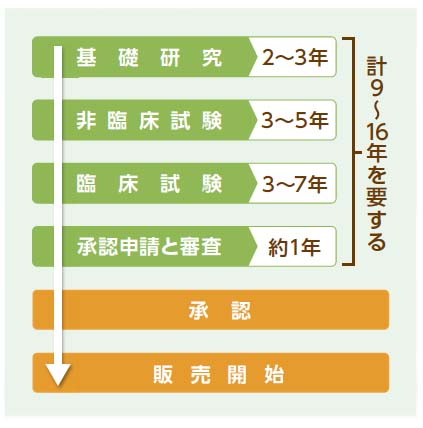
基礎研究
まずは薬効成分となることが期待される成分を発見する、あるいは作り出すところから始まります。先述した「スクリーニング」がこのプロセスにおける主な作業です。薬となる成分を探す方法は、自然界の様々な物質から抽出したり、既存の物質を化学的に合成したり、あるいはバイオテクノロジーを応用した手法で新たな物質を作り出したり、などが存在します。
こうして発見、創造された物質の性質や構造を調べ、スクリーニングにかけることで薬効成分となりうる物質の取捨選択が行われるのです。基礎研究には2年から3年を要します。
非臨床試験
発見された物質が生物に対してどのような効果をもたらすのかを研究するためのステップが非臨床試験です。モルモットやラットなどの実験動物や、培養された細胞に対して物質を投与し、有効性と安全性を研究します。
また、その物質がどのように動物の体内や細胞内に取り込まれ、どのように排出されるかを確認する動態調査や、品質、安定性の研究もこのステップの中で行われます。3年から5年という期間をかけてこの非臨床試験が行われた後、一定の安全性と有効性があると結論付けられれば、臨床試験の段階に進みます。
臨床試験
臨床試験では、いよいよ人体への投与に関する試験が行われます。いわゆる「治験」はこのステップを指します。非臨床試験を通過した薬の候補は「治験薬」と呼ばれ、この治験薬の段階ではまだヒトに対する有効性と安全性が完全に証明されていません。そのため、病院などの医療機関で、健康な人や患者の同意の元、実際にこの治験薬を投与して人体に対する安全性と有効性の確認を行います。
この臨床試験は、GCPという厳しい審査基準の下で第1相~第3相の3段階に分けて行われるものです。第1相では健康な人を対象にして副作用などの安全性を確認し、第2相では病気の人を対象に適切な投薬法や投薬量を調べます。その上で、第3相で多数の患者に投与し、既存の医薬品と比較する形で有効性と安全性の最終確認が行われ、その全てで安全性と有効性が証明されれば、ついに創薬における最終段階へと進むことができるのです。
臨床試験は3年から7年と、創薬プロセスの中では最も長い期間をかけて行われます。
承認申請と審査
非臨床試験と臨床試験を経て有効性、安全性、品質を確認できた治験薬は、厚生労働省の承認を得るために申請を行わなければなりません。さらに、医薬品医療機器総合機構および学識経験者などで構成する薬事・食品衛生審議会が治験薬に対して行われた全ての試験結果について審査が行われます。約1年に渡る審査を経て、厚生労働省によって「薬」としての承認が降りることで、治験薬は新薬として認められ、製造と販売が可能となるのです。
製造販売後調査・試験 第4相
新薬として世に出た後も、使用状況の確認が継続して行われます。開発中の時点では発見されなかった副作用や適切な使用法に関する情報を得るため、製薬企業の医薬情報担当者は発売後の新薬について情報を収集する必要があり、また薬自体も発売後に様々なチェックを行わなければなりません。
こうして得られた情報は、より安全な薬の使用方法や、薬自体の改良に活かされます。適応症の増加や治療効率の向上といった成果が得られる可能性があるだけでなく、次の新薬開発へのフィードバックにもなるため、この製造販売後調査も決しておろそかにはできません。
医薬品開発と知的財産 (特許とジェネリック薬品)

新薬の開発には膨大な時間がかかることはこれまで述べてきた通りですが、同時に開発の過程でかかるコストも莫大なものとなります。新薬開発の成功確率は実に22,407分の1という極めて低いもので、1つの新薬の発売の陰には22,406もの失敗が積み重なっているのです。当然、これらの失敗例にも研究開発費がかかっています。膨大なコストと時間が、1つの新薬が世に出るまでの間に費やされているのです。
そのため、それだけの時間とコストのかかった新薬に関する知的財産権については、適切に保護されなければ、製薬企業が新薬開発を継続することは到底できません。例えば、ある企業が開発した新薬が、他の企業にすぐ模倣されてしまった場合、新薬を開発した企業は本来その新薬によって得られたはずの利益を失ってしまうのです。故に、製薬企業は開発した新薬は一定期間その企業でのみ製造と販売を行い、他の企業が同じ薬品の製造販売を一切行えなくする必要があります。このときに新薬に対して取得されるのが特許権です。
特許権は、技術や製品などの発明を保護する権利で、その有効期限は出願されてから20年です。医薬品の場合は、厚生労働省での申請やそれに伴う審査期間が特許の有効期間に食い込んでしまうため、特例として最長5年の延長が認められる場合があります。新薬そのもののみならず、製法や用途なども特許で保護することが可能です。
ジェネリック医薬品
さて、特許が切れた新薬、即ち先発医薬品については、他の企業でも製造と販売が解禁されます。この先発医薬品と同じ有効成分で製造された後発の医薬品を「ジェネリック医薬品」と呼びます。ジェネリック医薬品として発売されるのは、新薬として発売されてから有効性と安全性を改めて確認するための再審査期間を満了し、なおかつ特許の有効期限を終えた先発医薬品と全く同等の成分を持つ薬品です。
ジェネリック医薬品の販売には、厚生労働省による製造販売承認が必要となるほか、先発医薬品と全く同等の成分であることを科学的に証明する資料が求められます。
アンメット・メディカル・ニーズへの挑戦
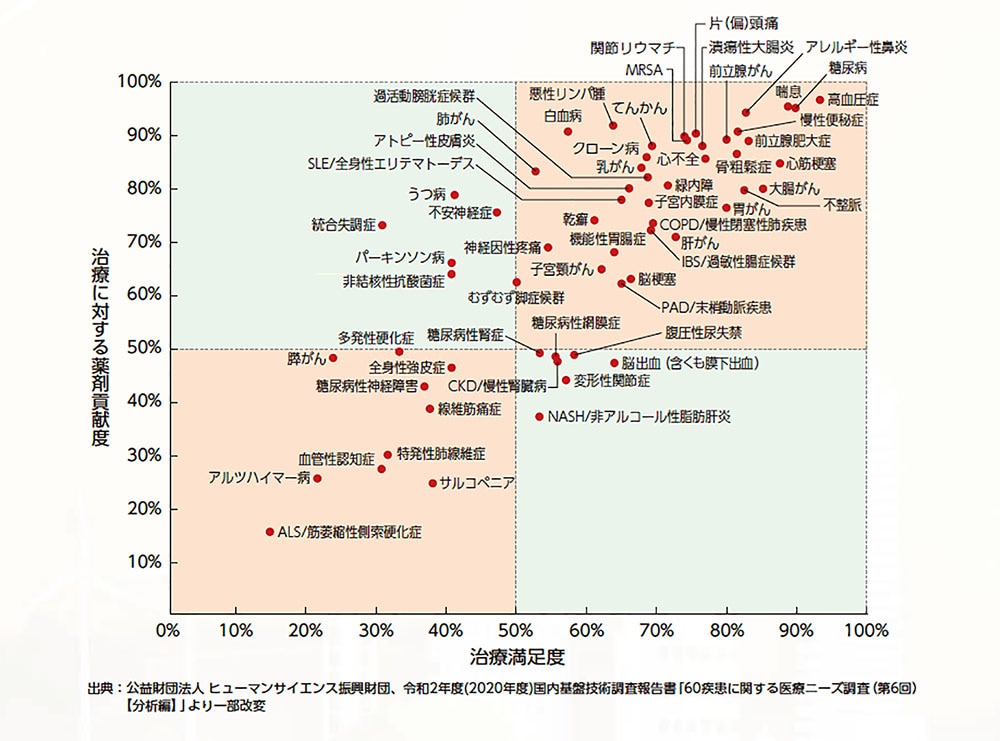
製薬業界が挑む課題の一つが、未だに満たされていない医療上の需要、即ち「アンメット・メディカル・ニーズ」です。医療技術や製薬技術が発達した現代においても、有効な治療方法が確立できていない疾患は少なからず存在します。こうした疾患に対する有効な新薬を開発することが、製薬業界全体の目標の一つなのです。
アンメット・メディカル・ニーズと治療における医薬品の貢献度は密接な関係にあります。日本製薬工業協会が実施したアンケート調査によれば、治療にあたって医薬品の貢献度が高い疾患は治療の満足度が高い、という結果が出ています。アンメット・メディカル・ニーズに応えるためには治療が難しい疾患に有効な医薬品の開発が求められているのです。
人々の暮らしをより健やかに、より豊かにするための新薬開発
新薬の研究開発は、膨大なコストと時間をかけながら、入念な検査を繰り返す中で行われていきます。こうした新薬の研究開発の原動力は、人々の暮らしをより健やかに、より豊かにしていきたいという願いにほかなりません。長い時間をかけた創薬の後、育薬によって有効性と安全性をさらに洗練されることで、医薬品は今日も多くの人々を救う力となっているのです。
製薬協プレゼンツ「製薬産業体験発見プロジェクト」参加者募集
製薬業界に興味のある学生のみなさん!
オンラインセミナーや交流会、グループワークを通して、製薬業界について深く学んでみませんか? 参加申込み受付中ですぜひご参加ください!
▼ 製薬産業を体験できるオンラインイベント参加申込み受付中










